আমরা আগের পোষ্ট গুলিতে আলোচনা করেছি বয়েলের সূত্র এবং চার্লসের সূত্র সম্পর্কে, আজ আমরা ঐই অধ্যায়ের একটি গুরুত্বপূর্ণ টপিক ‘বয়েল ও চার্লসের সমন্বয় সূত্র’ সম্পর্কে আলোচনা করতে চলেছি, বয়েল ও চার্লসের সমন্বয় সূত্র এর গাণিতিক রূপ ব্যাখা করতে চলেছি।
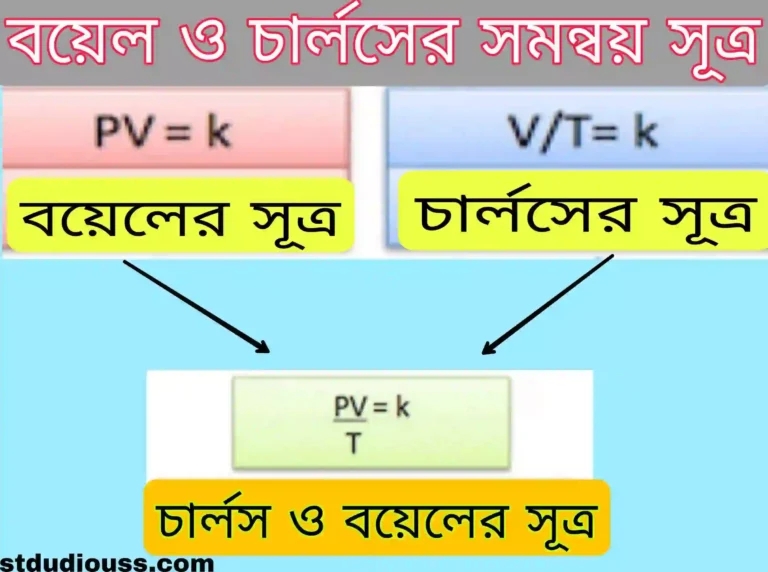
বয়েল ও চার্লসের সমন্বয় সূত্র (Combined form of Boyle’s & Charle’s Law) :
নির্দিষ্ট ভরের গ্যাসের চাপ ও আয়তনের গুণফল পরম স্কেলে গ্যাসটির উষ্ণতার সমানুপাতিক। অতএব, নির্দিষ্ট ভরের কোনো গ্যাসের প্রাথমিক অবস্থায় চাপ , আয়তন ও উন্নতা যথাক্রমে P1, V1, T1, এবং অস্তিম অবস্থায় চাপ, আয়তন ও উন্নতা যথাক্রমে P₂, V₂, T₂ হলে – (P1V1)/T1= (P₂V₂)/T₂ এটিই বয়েল ও চার্লসের সূত্রের সমন্বয়ে গঠিত সমীকরণ।
বয়েল ও চার্লসের সমন্বয় সূত্র বা PV = KT সমীকরণ প্রতিষ্ঠা :
বয়েলের সূত্রানুসারে আমরা জানি, নির্দিষ্ট ভরের গ্যাসের উন্নতা স্থির থাকলে গ্যাসের আয়তন চাপের সঙ্গে ব্যস্তানুপাতে পরিবর্তিত হয়। আবার, চার্লসের সূত্রানুযায়ী কোনো নির্দিষ্ট ভরের গ্যাসের চাপ স্থির থাকলে গ্যাসের আয়তন পরম উষ্ণতার সমানুপাতিক হয়।
ধরা যাক , T K উষ্ণতায় ও P চাপে নির্দিষ্ট ভরের গ্যাসের আয়তন V হলে,
বয়েলের সূত্রানুযায়ী, V∞1/P [ যখন উয়তা ( T ) স্থির ] P চার্লসের সূত্রানুযায়ী , V∞T [ যখন চাপ ( P ) স্থির ]
এখন চাপ ও উষ্ণতা উভয়েই পরিবর্তিত হলে , যৌগিক ভেদের উপপাদ্য অনুযায়ী,
V∞(1/P)×T বা V=K×(1/P)×T বা (P×V)/T=K ,[K=সমানুপাতিক ধ্রুবক ] নির্দিষ্ট ভরের গ্যাসের প্রাথমিক অবস্থায় চাপ, আয়তন, উষ্ণতা যথাক্রমে P1, V1, T1, এবং অন্তিম অবস্থায় চাপ, আয়তন, উষ্ণতা যথাক্রমে P₂, V₂, T₂ হলে বলা যায়
(P1V1)/T1= (P₂V₂)/T₂
এটি হল বয়েল ও চার্লসের সমন্বয় সূত্র।
বয়েল ও চার্লসের সমন্বয় সূত্র অনুসারে আমরা জানি , PV = ধ্রুবক = K বা , PV = KT এই PV = KT সমীকরণটিকে বলা হয় গ্যাসের অবস্থার = সমীকরণ । ধ্রুবক K- এর মান গ্যাসের প্রকৃতির ওপর নির্ভর করে না কিন্তু গ্যাসের মোলসংখ্যা বা ভরের ওপর নির্ভর করে।
আরও পড়ুন:-
- বয়েলের সূত্র (Boyle’s Law) | বয়েলের সূত্র গাণিতিক রূপ
- চার্লসের সূত্র (Charles’ Law) | চার্লসের সূত্রের ব্যাখা ও গাণিতিক রূপ
- গ্যাসের গতীয় তত্ত্বের স্বীকার্য : আদর্শ গ্যাস ও বাস্তব গ্যাস
আদর্শ গ্যাস কাকে বলে?
আদর্শ গ্যাস (Ideal gas) : যেসব গ্যাস যে-কোনো চাপ ও উষ্ণতায় বয়েল ও চার্লস উভয়ের সূত্র মেনে চলে , তাদের আদর্শ গ্যাস বলে। আদর্শ গ্যাসের ধারণা নিছক কল্পনামাত্র, বাস্তবে এমন কোনো গ্যাসের অস্তিত্ব নেই।
বাস্তব গ্যাস কাকে বলে ?
বাস্তব গ্যাস (Real gas) : যেসব গ্যাস বয়েল ও চার্লসের সূত্র মেনে চলে না, তাদের বাস্তব গ্যাস বলে । যেমন H2 , CO2 প্রভৃতি সবগুলিই বাস্তব গ্যাস। – O2 , N2 , –
কোন শর্তে বাস্তব গ্যাসগুলি আদর্শ গ্যাসের ন্যায় আচরণ করে??
খুব নিম্ন চাপ ও উচ্চ উষ্ণতায় বাস্তব গ্যাসগুলি আদর্শ গ্যাসের ন্যায় আচরণ করে। কারণ – নির্দিষ্ট ভরের কোনো বাস্তব গ্যাসের উয়তা স্থির রেখে চাপ খুব কমালে আয়তন অনেকটা বৃদ্ধি পায় । একইভাবে চাপ স্থির রেখে উন্নতা বৃদ্ধি করলেও আয়তন বৃদ্ধি পায়। ফলে , অণুগুলির মধ্যেকার ব্যবধান অর্থাৎ, আন্তরাণবিক দূরত্ব ক্রমশ বৃদ্ধি পায়। ফলে , অণুগুলির মধ্যেকার আকর্ষণ বলের মান ক্রমশ কমতে থাকে এবং একসময় তা শূন্য হয়ে যায়। যেহেতু , আদর্শ গ্যাসের অণুগুলির মধ্যেকার আকর্ষণ বলের মান শূন্য, তাই বলা যায় তখন বাস্তব গ্যাসগুলি আদর্শ গ্যাসের ন্যায় আচরণ করে।
Covered Topics: বয়েল ও চার্লসের সমন্বয় সূত্র, বয়েলের সূত্র ও চার্লসের সূত্রের সমন্বয় রূপ, চার্লসের ও বয়েলের সূত্রের গাণিতিক রূপ, আদর্শ গ্যাস কাকে বলে, চার্লসের সূত্র, বয়েলের সূত্র, চার্লসের সূত্রের গাণিতিক রূপ, বয়েলের সূত্রের গাণিতিক রূপ।