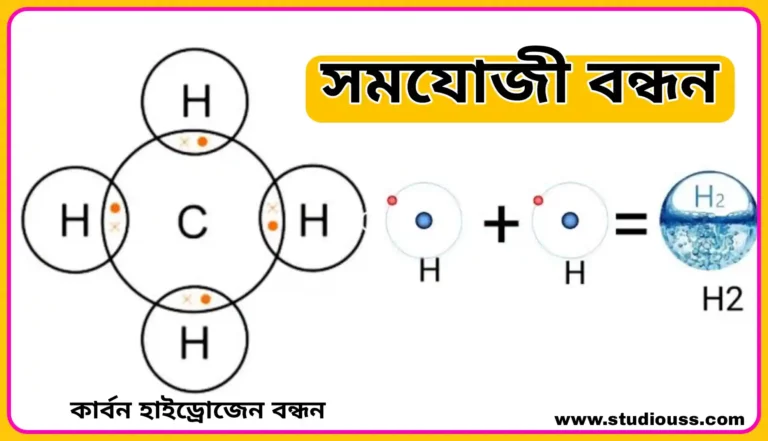
সমযোজী বন্ধন (Covalent bonding)
বিজ্ঞানী লুইস ( Lewis ) সমযোজী বন্ধন এর ধারণা দেন। যখন দুটি সমধর্মী মৌলের পরমাণু মিলিত হয়ে অণু গঠন করে তখন তাদের মধ্যে ইলেকট্রন দেওয়া – নেওয়া সম্ভব হয় না। এইরূপ দুটি পরমাণুর রাসায়নিক মিলনের সময় দুটি পরমাণুরই সবচেয়ে বাইরের কক্ষ থেকে সমান সংখ্যক ইলেকট্রন এসে এক বা একাধিক ইলেকট্রন জোড় গঠন করে।
অতঃপর উভয় পরমাণুই এই ইলেকট্রন জোড়কে সমানভাবে ব্যবহার করে রাসায়নিকভাবে যুক্ত হয় এবং উভয় পরমাণুই তাদের সবচেয়ে বাইরের কক্ষে ৪ টি ইলেকট্রন সংখ্যা ( হাইড্রোজেনের ক্ষেত্রে ২ টি ) পূরণ করে নিকটতম নিষ্ক্রিয় গ্যাসের পরমাণুর মতো সুস্থির ইলেকট্রন বিন্যাস লাভ করে। এইভাবে দুটি একই বা ভিন্ন মৌলের পরমাণুর মধ্যে সমভাবে ইলেকট্রন জোড় গ্রহণের মাধ্যমে যৌগ গঠনের ক্ষমতাকে মৌলের সমযোজ্যতা বলে এবং উৎপন্ন যৌগকে সমযোজী যৌগ (Covalent compound) বলে।
সমযোজ্যতার সাহায্যে অণু গঠনের সময় পরমানুগুলির মধ্যে যে বন্ধন সৃষ্টি হয় তাকে সমযোজী বন্ধন বলে।
সমযোজী বন্ধন তিন প্রকার, যথা –
1) এক – বন্ধন ,
2) দ্বি – বন্ধন ও
3) ত্রি – বন্ধন।
1) সমযোজী এক-বন্ধন ( Covalent Single bond) : যে সমযোজী বন্ধনে দুটি পরমাণু একটি ইলেকট্রন – জোড় সমভাবে ব্যবহার করে একটিমাত্র বন্ধন গঠন করে, তাকে সমযোজী এক-বন্ধন বলে।
এই বন্ধনকে ‘ — ’ চিহ্ন দ্বারা প্রকাশ করা হয়। যেমন –মিথেন, ক্লোরিন ক্লোরোফর্ম ইত্যাদির অণুতে সমযোজী এক-বন্ধন দেখা যায়।
2) সমযোজী দ্বি-বন্ধন ( Covalent Double bond ) : যে সমযোজী বন্ধনে দুটি পরমাণু দুটি ইলেকট্রন – জোড় সমভাবে ব্যবহার করে দুটি বন্ধনের সৃষ্টি করে , তাকে সমযোজী দ্বি – বন্ধন বলে।
এই বন্ধনকে ‘=’ চিহ্ন দ্বারা প্রকাশ করা হয় । যেমন অক্সিজেন, ইথিলিন প্রোপিলিন, বেঞ্জিন ইত্যাদি অণুতে সমযোজী দ্বি-বন্ধন দেখা যায়।
3) সমযোজী ত্রি-বন্ধন (Covalent triple bond) : যে সমযোজী বন্ধনে দুটি পরমাণু ওটি ইলেকট্রন – জোড় সমভাবে ব্যবহার করে তিনটি বন্ধনের সৃষ্টি করে , তাকে সমযোজী ত্রি-বন্ধন বলে।
উদাহরণ – অ্যাসিটিলিন , প্রোপাইন , নাইট্রোজেন , HCN ইত্যাদি অণুতে সমযোজী ত্রি -বন্ধন দেখা যায়।
আরও পড়ুন :-
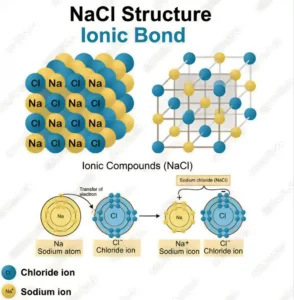
- সোডিয়াম ক্লোরাইড এর কেলাস গঠন | NaCl এর গঠন ব্যাখ্যা
- আয়নিক বন্ধন বা তড়িৎযোজী বন্ধন কাকে বলে | আয়নিক বন্ধনের বৈশিষ্ট্য
- জারণ ক্ষমতা ও বিজারণ ক্ষমতা কি? | পর্যায় শ্রেণি জারণ বিজারণ ধর্ম কিভাবে পরিবর্তিত হয়?
- হাইড্রোজেন কে দুষ্ট মৌল বলা হয় কেন? – ব্যাখা
সমযোজী বন্ধনের বৈশিষ্ট্য
সমযোজী বন্ধনের বৈশিষ্ট্যগুলি হল-
1) বন্ধনে আবদ্ধ পরমাণু দুটির তড়িৎ – ঋণাত্মকতার মান সমান বা প্রায় সমান হয়।
2) সমযোজী বন্ধন গঠনে অংশগ্রহণকারী পরমাণু দুটি তাদের সর্ববহিস্থ কক্ষ থেকে সমসংখ্যক ইলেকট্রন প্রদানের মাধ্যমে ইলেকট্রন – জোড় গঠন করে এবং সমভাবে ব্যবহারের ফলে নিকটতম নিষ্ক্রিয় গ্যাসের ন্যায় ইলেকট্রন বিন্যাস লাভ করে।
3) সমযোজী বন্ধনের নির্দিষ্ট অভিমুখ আছে। সমযোজী বন্ধন আয়নীয় বন্ধনের তুলনায় শক্তিশালী হয়।
4) একই পরমাণু দ্বারা গঠিত সমযোজী বন্ধনগুলি অধ্রুবীয় (যেমন – H2 , F , ইত্যাদি) এবং ভিন্ন পরমাণু দ্বারা গঠিত সমযোজী বন্ধনগুলি সাধারণত ধ্রুবীয় হয়। ( যেমন H—CI , OH ইত্যাদি)।
সমযোজী এক বন্ধনের উদাহরণ:
ফ্লুওরিন (F2)-এর গঠন : 9F অণুর ইলেকট্রন বিন্যাস হল K (2) L (7)। ফ্লুওরিন পরমাণুর সর্ববহিস্থ কক্ষে 7 টি ইলেকট্রন থাকে। ফ্লুওরিন অণুতে দুটি ফ্লুওরিন পরমাণুর প্রত্যেকে একটি করে ইলেকট্রন দিয়ে 1 টি ইলেকট্রন – জোড় গঠন করে। এইভাবে সমযোজী এক-বন্ধন গঠনের মাধ্যমে ফ্লুওরিন পরমাণু নিজ নিজ সর্ববহিস্থ কক্ষে ৪ টি ইলেকট্রন লাভ করে নিষ্ক্রিয় গ্যাস নিয়নের মতো ইলেকট্রন – কাঠামো লাভ করে।
সমযোজী দ্বি বন্ধনের উদাহরণ:
অক্সিজেন (O2)-এর গঠন : অক্সিজেন পরমাণুর যোজন কক্ষে 6 টি ইলেকট্রন বর্তমান। অক্সিজেন অণু গঠনের সময় দুটি অক্সিজেন পরমাণুর প্রত্যেকে 2 টি করে ইলেকট্রন দিয়ে 2 টি ইলেকট্রন – জোড় গঠন করে। এই 2 টি ইলেকট্রন – জোড়কে 2 টি অক্সিজেন পরমাণু সমভাবে ব্যবহার করে নিকটতম নিষ্ক্রিয় গ্যাস নিয়ন (Ne) – এর মতো ইলেকট্রন – বিন্যাস লাভ করে এবং O অণু গঠিত হয়।
সমযোজী ত্রি বন্ধনের উদাহরণ:
নাইট্রোজেন (N2) – এর গঠন : নাইট্রোজেন পরমাণুর যোজন কক্ষে 5 টি ইলেকট্রন বর্তমান। নাইট্রোজেন অণু গঠনের সময় প্রতিটি নাইট্রোজেন পরমাণু 3 টি করে ইলেকট্রন ব্যবহার করে তিনটি ইলেকট্রন – জোড় গঠন করে এবং নিষ্ক্রিয় গ্যাসের ইলেকট্রন – কাঠামো লাভ করে। তিনটি ইলেকট্রন – জোড় ব্যবহার করার কারণে নাইট্রোজেনের সমযোজ্যতা 3 হয়।
Covered Topics:- সমযোজী বন্ধন কাকে বলে, সমযোজী বন্ধন কয় প্রকার ও কি কি, সমযোজী বন্ধনের বৈশিষ্ট্য, কোভালেন্ট বন্ড কাকে বলে, সমযোজী বন্ধন কিভাবে গঠিত হয়, সমযোজী বন্ধন বলতে কি বোঝায়, সমযোজী বন্ধন গঠনের শর্ত, সমযোজী বন্ধনের উদাহরণ



Sir, Mcq diyen please