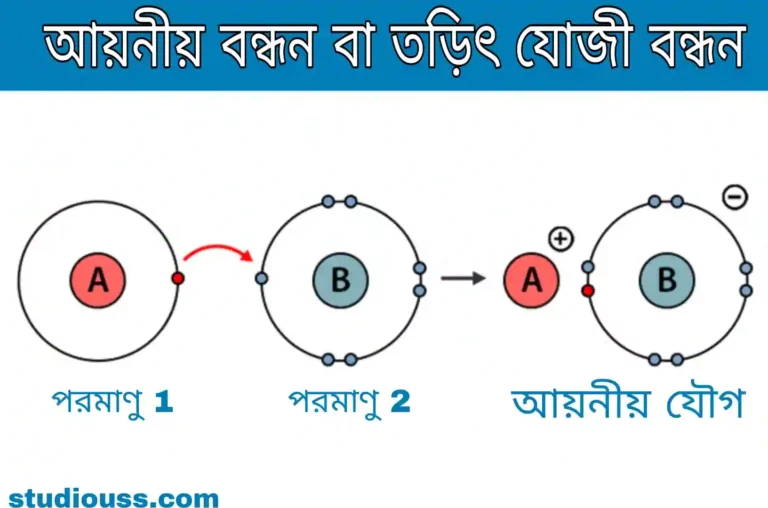
আয়নিক বন্ধন বা তড়িৎযোজী বন্ধন (lonic or electrovalent bonding)
ঊনবিংশ শতকের শেষ দশকে র্যালে ও র্যামসে (Rayleigh and Ramsay) কর্তৃক নোবেল গ্যাস বা নিষ্ক্রিয় গ্যাস (He , Ne , Ar , Kr , Xe , Rn) আবিষ্কার এবং তড়িৎ পরিবাহিতা ও অন্যান্য পরীক্ষা থেকে NaCl- এর মতো যৌগে আয়নের অস্তিত্ব প্রমাণিত হয় আয়নীয় বন্ধন বা আয়নিক বন্ধন বা তড়িৎযোজী বন্ধনের প্রথম কল্পনা করেন বিজ্ঞানী কোসেল (Kossel)। যখন একটি ধাতব মৌলের পরমাণু ও একটি অধাতব মৌলের পরমাণু রাসায়নিক সংযোগে অণু গঠন করে তখন ধাতব মৌলের পরমাণুর সবচেয়ে বাইরের কক্ষের এক বা একাধিক ইলেকট্রন অধাতব মৌলের পরমাণুর সবচেয়ে বাইরের কক্ষে স্থানান্তরিত হয়। পরমাণু দুটির মধ্যে ইলেকট্রনের আদানপ্রদান এমনভাবে হয় যাতে উভয় পরমাণুই নিকটতম নিষ্ক্রিয় গ্যাসের পরমাণুর মতো ইলেকট্রন বিন্যাস লাভ করে এবং তাদের বাইরের কক্ষে ৪ টি (He- এর মতো 2 টি) ইলেকট্রন সংখ্যা পূর্ণ হয়। এইভাবে ধাতব মৌলের পরমাণু ইলেকট্রন বর্জন করে ধনাত্মক আয়নে (ক্যাটায়নে) এবং অধাতব মৌলের পরমাণু ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে (অ্যানায়নে) পরিণত হয়। অতঃপর বিপরীতধর্মী আয়ন দুটি পরস্পর স্থির তড়িদাকর্ষণে যুক্ত হয়ে যৌগের অণু গঠন করে। এইভাবে পরমাণু দুটির মধ্যে যে বন্ধন সৃষ্টি হয় তাকে আয়নীয় বন্ধন বা তড়িৎযোজী বন্ধন বলে। পরমাণু দুটির মধ্যে এই রকম হলেকট্রন স্থানান্তরের মাধ্যমে যৌগ গঠনের ক্ষমতাকে মৌলের তড়িৎযোজ্যতা বলে এবং উৎপন্ন যৌগকে তড়িৎযোজী যৌগ বলে।
আয়নিক বন্ধন বা তড়িৎযোজী বন্ধন কাকে বলে?
তড়িৎযোজী বন্ধন বা আয়নিক বন্ধন: তড়িৎযোজ্যতার সাহায্যে যৌগ গঠনের সময় পরমাণুগুলির মধ্যে যে রাসায়নিক বন্ধন সৃষ্টি হয় তাকে তড়িৎযোজী বন্ধন বা আয়নিক বন্ধন বলে।
আয়নিক বন্ধনের বৈশিষ্ট্য
আয়নীয় বন্ধনের বৈশিষ্ট্যগুলি হল তড়িৎ –
1) ধনাত্মক ও তীব্র তড়িৎ – ঋণাত্মক মৌলের মধ্যে এই প্রকার বন্ধন গঠিত হয়। অর্থাৎ , আয়নিক বন্ধনে অংশগ্রহণকারী মৌল দুটির মধ্যে তড়িৎ – ঋণাত্মকতার উচ্চ পার্থক্য থাকে।
2) আয়নীয় বন্ধনের কোনো নির্দিষ্ট অভিমুখ থাকে না। কারণ – একটি আয়ন বিপরীত তড়িগ্রস্ত আয়নকে যে – কোনো দিক থেকে আকর্ষণ করে।
3) সমযোজী বন্ধনের তুলনায় আয়নীয় বন্ধন দুর্বল প্রকৃতির হয়। এই কারণে ধ্রুবীয় বা পোলার দ্রাবকের উপস্থিতিতে আয়নীয় বন্ধন ভেঙে ক্যাটায়ন ও অ্যানায়নগুলি পরস্পর থেকে বিচ্ছিন্ন হয়ে দূরে সরে যায় ।
আরও পড়ুন:-
- চার্লসের সূত্র (Charles’ Law) | চার্লসের সূত্রের ব্যাখা ও গাণিতিক রূপ
- বয়েল ও চার্লসের সমন্বয় সূত্র | আদর্শ গ্যাস | বাস্তব গ্যাস
- আদর্শ গ্যাসের সমীকরণ PV=nRT প্রতিষ্ঠা করো | সর্বজনীন গ্যাস ধ্রুবক
আয়নীয় বন্ধনের উদাহরণ
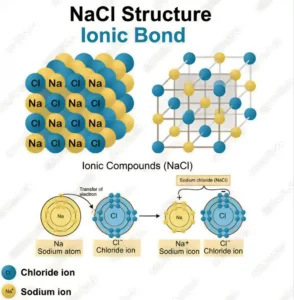
সোডিয়াম ক্লোরাইডের (NaCl) গঠন :
সোডিয়াম পরমাণুর ইলেকট্রন বিন্যাস হল 2,8,1 এবং ক্লোরিন পরমাণুর ইলেকট্রন বিন্যাস হল 2 , 8 , 7 ; সোডিয়াম পরমাণু তার সবচেয়ে বাইরের কক্ষের ইলেকট্রনটি ক্লোরিনের সবচেয়ে বাইরের কক্ষে স্থানান্তরিত করে এবং সোডিয়াম ও ক্লোরিন পরমাণু উভয়েই বাইরের কক্ষে ৪ টি ইলেকট্রন সংখ্যা পূর্ণ করে। Na পরমাণু একটি ইলেকট্রন বর্জন করায় তা Na+ আয়নে পরিণত হয় এবং Cl পরমাণু 1 টি ইলেকট্রন গ্রহণ করায় তা Cl- আয়নে পরিণত হয়। অতঃপর Na+ এবং Cl- আয়ন স্থির তড়িতাকর্ষণের যুক্ত হয়ে NaCl গঠন করে।

আয়নিক বন্ধনের বৈশিষ্ট্য
সোডিয়াম পরমাণু 1 টি ইলেকট্রন বর্জন করে , তাই Na- এর যোজ্যতা=1। আবার ক্লোরিন পরমাণু একটি ইলেকট্রন গ্রহণ করে তাই ক্লোরিনের যোজ্যতা 1।
লিথিয়াম হাইড্রাইডের (LiH) গঠন : লিথিয়াম পরমাণুর (Li) ইলেকট্রন বিন্যাস 2 , 1 এবং হাইড্রোজেন পরমাণুর (1H) ইলেকট্রন বিন্যাস 1। লিথিয়ামের সবচেয়ে বাইরের কক্ষের 1 টি ইলেকট্রন হাইড্রোজেনের সবচেয়ে বাইরের কক্ষে স্থানান্তরিত হয়ে উভয়ের বাইরের কক্ষের ইলেকট্রন সংখ্যা 2 হয় এবং নিষ্ক্রিয় মৌল হিলিয়ামের ইলেকট্রন বিন্যাস লাভ করে।

আয়নিক বন্ধন কাকে বলে
Li পরমাণু Li+ আয়নে এবং H পরমাণু H- আয়ণে পরিণত হয় ও এরা পরস্পর স্থির তড়িৎ আকর্ষণে যুক্ত হয়ে LiH গঠন করে।
Covered Topics:- আয়নিক বন্ধন কাকে বলে?, আয়নীয় বন্ধন কাকে বলে?, তড়িৎযোজী বন্ধন কাকে বলে, আয়নীয় বন্ধনের বৈশিষ্ট্য, সোডিয়াম ক্লোরাইড এর গঠন, NaCl এর গঠন, আয়নিক বন্ধনের উদাহরণ, তড়িৎযোজী বন্ধনের বৈশিষ্ট



Pingback: তড়িৎ বিশ্লেষণ (Electrolysis) কাকে বলে | জলের তড়িৎ বিশ্লেষণ বর্ণনা কর – Studious