হ্যালো বন্ধুরা, আজ আমাদের আলোচ্য বিষয় হল তাপ অধ্যায়ের ” ক্যালোরিমিতির মূলনীতি “। আমরা এই পোস্ট টিতে জানব ক্যালরিমিতি কাকে বলে? ক্যালরিমিতির মূলনীতি কি? তাপীয় সাম্য বলতে কি বোঝায়? ক্যাল রিমিটার কি? ক্যালরিমিটার কি কাজে ব্যবহৃত হয় ইত্যাদি। সুতরাং শুরু করা যাক ক্যালরিমিতির মূলনীতি।
ক্যালোরিমিতি কাকে বলে? ( what is meant by Calorimetry)
ক্যালোরিমিতি : পদার্থবিজ্ঞানের যে শাখায় তাপশক্তির পরিমাপ বিয়য়ে আলোচনা করা হয়, তাকে ক্যালোরিমিতি বলা হয়৷
তাপীয় আদানপ্রদানকালে বস্তু দ্বারা গৃহীত বা বর্জিত তাপের পরিমাণ এবং তার ফলে বস্তুর উষ্ণতা বৃদ্ধি বা হ্রাস, তাপীয় সাম্যে দুটি বা ততোধিক বস্তু দ্বারা গঠিত সংস্থার চূড়ান্ত উষ্ণতার মান নির্ণয় ইত্যাদি হল এই শাখার আলোচনার বিষয়বস্তু।
ক্যালোরিমিতির মূলনীতি (Fundamental principles of Calorimetry)
ক্যালোরিমিতির মূলনীতি (Calorimetry principle) : ভিন্ন উন্নতায় থাকা দুটি বস্তুকে তাপীয় সংযোগে আনা হলে উষ্ণতর বস্তু তাপ বর্জন করে শীতল হয় এবং শীতলতর বস্তু ওই তাপ গ্রহণ করে উত্তপ্ত হয়। তাপের এই গ্রহণ ও বর্জন ততক্ষন চলতে থাকে যতক্ষণ না দুটি বস্তু সমান উন্নতায় আসে, অর্থাৎ, তাপীয় সাম্য প্রতিষ্ঠিত হয়।
তাপীয় সাম্যে উষ্ণতর বস্তু কর্তৃক বর্জিত তাপ = শীতলতর বস্তু কর্তৃক গৃহীত তাপ — এই সমতাসূচক বিবৃতিটিকেই ক্যালোরিমিতির মূলনীতি বলে অভিহিত করা হয়।
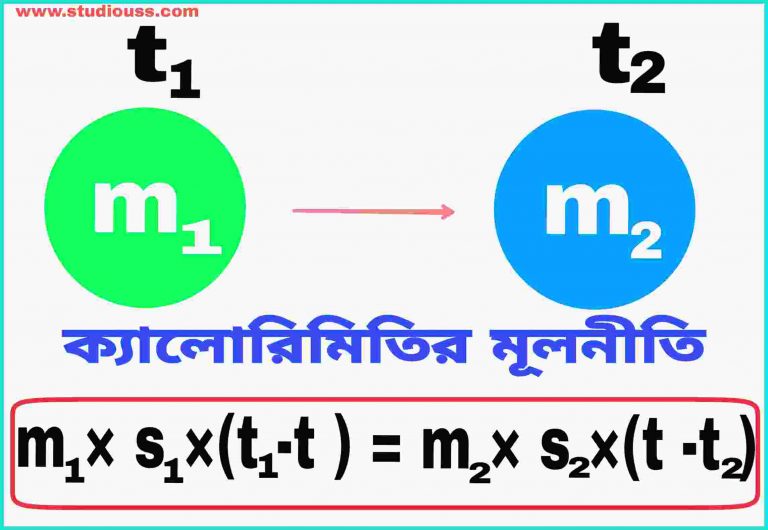
ক্যালোরিমিতির মূলনীতির ব্যাখ্যা : ধরা যাক, m1 , ও m2 ভরের বস্তু দুটির উপাদানের আপেক্ষিক তাপ যথাক্রমে S1 , ও S2 এবং প্রাথমিক উন্নতা যথাক্রমে t1 ও t2 ( t1 > t2 )। প্রত্যক্ষ বা পরোক্ষ তাপীয় সংযোগে আনা হলে প্রথম বস্তু তাপ বর্জন করে , যা গ্রহণের ফলে দ্বিতীয় বস্তুর উষ্ণতা বৃদ্ধি পায়। তাপীয় সাম্যে সংস্থার চূড়ান্ত উষ্ণতা t ( t2 < t< t1 ) হলে, ক্যালোরিমিতির মূলনীতি অনুসারে, প্রথম বস্তু কর্তৃক বর্জিত তাপ = দ্বিতীয় বস্তু কর্তৃক গৃহীত তাপ।
অর্থাৎ , m1×s1×(t1-t) = m2×s2× (t- t2 )।
- অভ্যন্তরীণ পূর্ণ প্রতিফলন কাকে বলে ও শর্ত | মরুভূমির মরীচিকা
- আর্কিমিডিসের নীতি ব্যাখা | আর্কিমিডিসের সূত্রের প্রয়োগ
- রাদারফোর্ডের পরীক্ষা | রাদারফোর্ডের আলফা কণার বিচ্ছুরণ পরীক্ষা
- প্লবতা (Buoyancy) কাকে বলে | প্লবতার বৈশিষ্ট্য | প্লবতার সূত্র
ক্যালোরিমিতির মূলনীতি প্রযোজ্য হওয়ার শর্ত :
- তাপীয় আদানপ্রদান শুধুমাত্র সংযোগে থাকা বস্তুগুলির মধ্যেই সীমাবদ্ধ থাকবে। অর্থাৎ , পারিপার্শ্বিক বা পরিবেশের সঙ্গে বিকিরণ বা অন্য পদ্ধতিতে কোনোভাবেই তাপের বিনিময় যেন না হয়।
- বস্তুগুলির মধ্যে কোনোরকম রাসায়নিক বিক্রিয়া যেন না হয় বা একটি তরল হলে তাতে যেন অন্য বস্তুগুলি দ্রাব্য না হয়। কারণ উভয়ক্ষেত্রেই অতিরিক্ত কিছু পরিমাণ তাপের উদ্ভব বা শোষণ হয় , যা এক্ষেত্রে বিবেচনাযোগ্য নয়।
- তাপ সঞ্চালনের সময় তাপশক্তির অন্য কোনো শক্তিতে রূপান্তর যেন না ঘটে ।
ক্যালোরিমিতিক তরল (Calorimetric liquid): ক্যালোরিমিতিতে বস্তু বা বস্তুসংস্থার চূড়ান্ত উষ্ণতা বা আনুষঙ্গিক অন্যান্য পরিমাপের ক্ষেত্রে যে তরল ব্যবহার করা হয়, তাকেই ক্যালোরিমিতিক তরল বলা হয়৷
ক্যালোরিমিটার (Calorimeter) কি?
ক্যালোরিমিতি সম্পর্কিত বেশিরভাগ পরীক্ষায় আংশিক তরলপূর্ণ যে তামার তৈরি চোঙাকৃতি পাত্র ব্যবহৃত হয় , তাকে ক্যালোরিমিটার বলে।
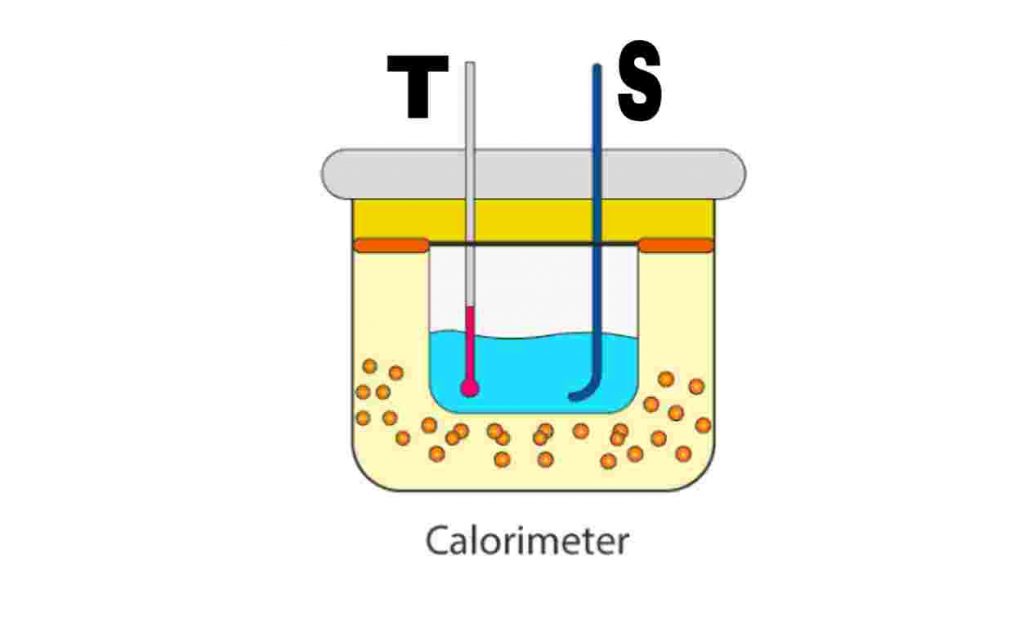
ক্যালোরিমিটারের ব্যবহার : তাম্রনির্মিত একটি আলোড়ক ( Stirrer ) S- এর সাহায্যে ক্যালোরিমিতিক তরলকে ভালোভাবে নাড়ানো হয় এবং একটি থার্মোমিটার T- এর সাহায্যে আলোড়িত তরলসহ ক্যালোরিমিটারে রাখা যে – কোনো উষ্ণ বস্তুর উষ্ণতা পরিমাপ করা হয়। কোনো উত্তপ্ত বস্তুকে ক্যালোরিমিটারে ফেলা হলে ওই বস্তু ও ক্যালোরিমিটার বা ক্যালোরিমিতিক তরলের মধ্যে তাপ বিনিময় ঘটে। এই বিনিময়ের দ্বারা তাপীয় সাম্য প্রতিষ্ঠিত হলে, ওই ক্যালোরিমিটার অবস্থায় গৃহীত তাপ = বর্জিত তাপ সম্পর্ক ব্যবহার করে প্রয়োজনীয় গণনাগুলি করা হয়।
ক্যালোরিমিটার থেকে তাপক্ষয় রোধ করার জন্য প্রদত্ত ব্যবস্থা গুলি নেওয়া হয়।
ক্যালোরিমিটারকে কর্ক , কাঠ , কার্ডবোর্ড ইত্যাদি কুপরিবাহী পদার্থের আবরণের মধ্যে বসানো হয় ও ক্যালোরিমিটারের মুখে একটি কুপরিবাহী পদার্থের তৈরি ঢাকনা রাখা হয়। এতে পরিবহণ পদ্ধতিতে তাপক্ষয় অনেক কম হয়।
পরিচলন পদ্ধতিতে তাপক্ষয় রোধ করার জন্য ক্যালোরিমিটারকে একটি আবদ্ধ পাত্রের মধ্যে রাখা হয়। পাত্র ও ক্যালোরিমিটারের মাঝে তুলো , পশম ইত্যাদি কুপরিবাহী পদার্থ রাখা হয়।
ক্যালোরিমিটারের বাইরের তলটি খুব ভালোভাবে পালিশ করা থাকে অথবা , নিকেলের চকচকে প্রলেপ দেওয়া থাকে । ফলে , বিকিরণ পদ্ধতিতে তাপক্ষয় কম হয় ।



Pingback: আইসোটোপ (Isotope) কাকে বলে? | আইসোবার | আইসোটোন – Studious
Pingback: আলোর প্রতিসরণ | প্রতিফলনের নিয়ম ও সূত্র | প্রতিসরাঙ্ক ও স্নেলের সূত্র – Studious
Pingback: পদার্থের ভৌত ধর্ম কাকে বলে? | ভৌত ধর্ম গুলির উল্লেখ করো – Studious