আদর্শ গ্যাস কাকে বলে? (what is ideal gas)
যে সমস্ত গ্যাস সাধারণ উষ্ণতা ও চাপে বয়েলের সূত্র, চার্লসের সূত্র, এবং আদর্শ গ্যাসের সমীকরণ PV=nRT মেনে চলে তাদের আদর্শ গ্যাস বলে।
বাস্তব গ্যাস কাকে বলে? (What is real gas)
যে সমস্ত গ্যাস যে কোনো চাপ এবং তাপমাত্রায় আদর্শ গ্যাস সমীকরণ PV = nRT -কে সঠিকভাবে মেনে চলে না তাদের বাস্তব গ্যাস বলে।
আদর্শ গ্যাস ও বাস্তব গ্যাসের মধ্যে পার্থক্য (Difference between Ideal gas and Real gas)
1) আদর্শ গ্যাস সকল উষ্ণতা ও চাপে PV = nRT সমীকরণ মেনে চলে।, বাস্তব গ্যাস PV = nRT সমীকরণ মেনে চলে না।
2) প্রকৃতিতে কোন গ্যাস আদর্শ গ্যাস নয়, প্রকৃতিতে সব গ্যাসীয় পদার্থ বাস্তব গ্যাস।
3) আদর্শ গ্যাসের ক্ষেত্রে অনুগুলির মধ্যে পারস্পরিক আকর্ষণ ক্রিয়া করে না।, বাস্তব গ্যাসের ক্ষেত্রে অনুগুলির মধ্যে পারস্পরিক আকর্ষণ ক্রিয়া করে।
4) আদর্শ গ্যাসের ক্ষেত্রে অনুগুলির আয়তন পাত্রের তুলনায় নগণ্য হয়, বাস্তব গ্যাসের ক্ষেত্রে অনুগুলির আয়তন পাত্রের তুলনায় নগণ্য হয় না।
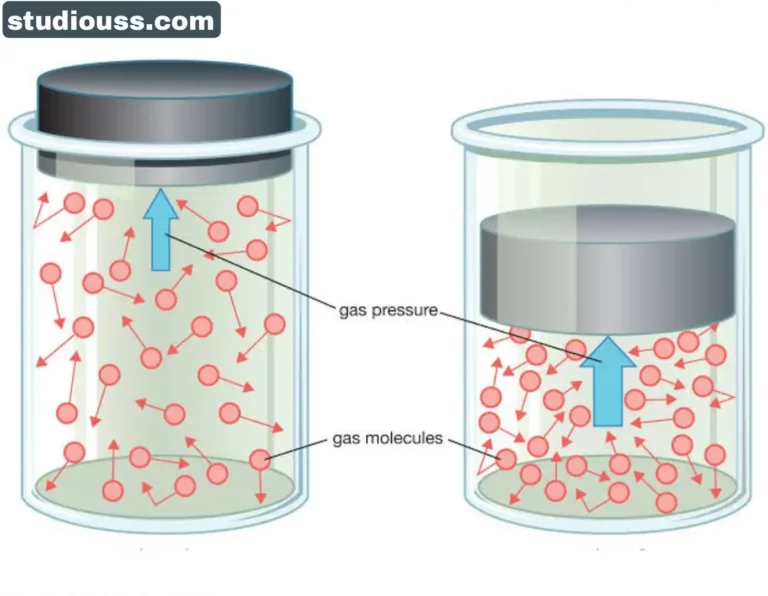
গ্যাসের গতীয় তত্ত্বের মূল স্বীকার্যসমূহ (Basic Assumptions of Kinetic Theory of Gases)
বিভিন্ন ঘটনা বিশেষত ব্রাউনীয় গতি পর্যবেক্ষণ করে আমরা জানতে পারি যে, কোনো গ্যাস কিছু অণুর সমষ্টি এবং এই অণুগুলি দ্রুত ও অবিন্যস্তভাবে সতত সঞ্চরণশীল। গ্যাস অণুগুলির গতির ফলেই তাপের উদ্ভব ঘটে। এই তথ্য দুটি গ্যাসের গতীয় তত্ত্বের মূল ভিত্তি। গ্যাসের গতীয় তত্ত্ব কয়েকটি স্বীকার্যের ওপর প্রতিষ্ঠিত। স্বীকার্যগুলি নিম্নরূপ :
(1) সকল গ্যাসই অসংখ্য অণুর সমষ্টি। একই গ্যাসের সকল অণুগুলিই সব বিষয়ে একইরকমের। কিন্তু ভিন্ন ভিন্ন গ্যাসের অণুগুলি ভিন্ন ভিন্ন ধরনের। গ্যাস অণুগুলি বিন্দু ভরের (point mass- এর) মত। এদের আয়তন পাত্রের আয়তনের তুলনায় খুবই নগণ্য।
(2) অণুগুলি সর্বদাই গতিশীল। এই গতি সম্পূর্ণ এলোমেলো, অর্থাৎ অণুগুলি সম্ভাব্য সকল দিকে ধাবমান এবং এদের বেগ শূন্য থেকে অসীমের মধ্যে যে-কোনো মানের হতে পারে।
(3) অণুগুলি দৃঢ় এবং আদর্শ স্থিতিস্থাপক গোলকের ন্যায় আচরণ করে। অণুগুলির পাত্রের দেয়ালের সঙ্গে এবং পরস্পরের সঙ্গে অনবরত যে সংঘর্ষ হয় সেগুলি পূর্ণ স্থিতিস্থাপক সংঘর্ষ। অতএব এধরনের সংঘর্ষে অণুগুলির গতিবেগ পরিবর্তিত হয়, কিন্তু গতিশক্তি ও রৈখিক ভরবেগ সংরক্ষিত থাকে।
(4) চলাচলের সময় অণুগুলি পরস্পরের সঙ্গে এবং পাত্রের দেয়ালের গায়ে ধাক্কা খায়। প্রতিটি সংঘর্ষের পর অণুগুলির বেগের মান ও অভিমুখ উভয়ই পরিবর্তিত হয়। এইসব সংঘর্ষ ঘটলেও স্থিতাবস্থায় পাত্রের অভ্যন্তরে যে – কোনো স্থানে একক আয়তনে অণুর সংখ্যা অর্থাৎ আণবিক ঘনত্ব অপরিবর্তিত থাকে। অণুগুলি পাত্রের দেয়ালের সঙ্গে কিংবা পরস্পরের সঙ্গে কোনো আকর্ষণ বা বিকর্ষণ বল অনুভব করে না। সুতরাং অণুগুলির কোনো স্থিতিশক্তি নেই , এদের সম্পূর্ণ শক্তিই গতিশক্তি।
(5) কোনো অণু একটি সংঘর্ষ ঘটানোর পর তার পরের সংঘর্ষটি ঘটানোর আগে পর্যন্ত সমবেগে চলে (নিউটনের প্রথম গতিসূত্রানুসারে)।
(6) যে সময় ধরে একটি সংঘর্ষ ঘটে তা মুক্তপথ অতিক্রম করার সময়ের তুলনায় অতি নগণ্য। অর্থাৎ সংঘর্ষগুলি মুহূর্তের মধ্যেই সংঘটিত হয় বা সংঘর্ষগুলি তাৎক্ষণিক।
সকল বাস্তব গ্যাসের ক্ষেত্রে উপরিউক্ত স্বীকার্যগুলি সব সময়ে খাটে না। যে গ্যাস উপরিউক্ত স্বীকার্যগুলি মেনে চলে তাকে আদর্শ গ্যাস (ideal বা perfect gas ) বলা হয়। গ্যাসের গতীয় তত্ত্বে এই সূত্রগুলিকে কোনোভাবেই ব্যবহার করা হয় না। গতীয় তত্ত্বের বৈশিষ্ট্য হল, ওপরের স্বীকার্যগুলির মাধ্যমে সম্পূর্ণ তাত্ত্বিকভাবে গ্যাসের ধর্মগুলির বিশ্লেষণ করা হয়, এবং গ্যাসের সূত্রগুলিকে তাত্ত্বিকভাবেই প্রতিষ্ঠা করা হয়। অবশেষে দেখা যায়, এই তাত্ত্বিক বিশ্লেষণের মাধ্যমে পরীক্ষালব্ধ প্রতিটি সূত্রকেই নির্ভুলভাবে নির্ণয় করা সম্ভব। এটিই গ্যাসের গতীয় তত্ত্বের সাফল্য ।
আদর্শ গ্যাস সূত্রগুলির সীমাবদ্ধতা (Limitations of Ideal Gas Laws)
যে গ্যাস বয়েল এবং চার্লসের সূত্র পুরোপুরি নিখুঁতভাবে মেনে চলে তাকে আদর্শ গ্যাস বলা হয় । প্রকৃতপক্ষে কোনো গ্যাস – ই আদর্শ গ্যাস নয়, সব গ্যাসই বাস্তব গ্যাস (real gas)। বাস্তব গ্যাসগুলির আচরণ সকল অবস্থায় আদর্শ গ্যাসের মতো হয় না। সাধারণ উষ্ণতা ও চাপে বাস্তব গ্যাসগুলি মোটামুটি বয়েলের সূত্র মানে। কিন্তু নিম্ন উয়তায় ও উচ্চচাপে বাস্তব গ্যাসগুলি বয়েলের সূত্র , চার্লসের সূত্র ইত্যাদি আদর্শ গ্যাস সূত্রাবলি ভালোভাবে মেনে চলে না। n mol আদর্শ গ্যাসের ক্ষেত্রে সঠিকভাবে প্রযোজ্য সমীকরণটি হল pV = nRT
বাস্তব গ্যাস প্রধানত দুটি কারণে এই সমীকরণটি মেনে চলে না।
গতিতত্ত্বের মূল স্বীকার্যগুলির মধ্যে ধরা হয়েছে, গ্যাসের অণুগুলি বিন্দুভর এবং অণুগুলির মোট আয়তন গ্যাস দ্বারা অধিকৃত আয়তনের তুলনায় উপেক্ষণীয়। কিন্তু বাস্তবে যত ক্ষুদ্রই হোক না কেন প্রত্যেকটি অণুরই একটি নির্দিষ্ট আয়তন আছে। অধিক চাপে এবং কম উন্নতায় গ্যাসের আয়তন যখন কম থাকে তখন অণুগুলির মোট আয়তনকে আর উপেক্ষা করা চলে না। ফলে গ্যাসের অণুগুলির সরণের জন্য কার্যকর আয়তন (effective volume) ওর মোট আয়তন V অপেক্ষা কিছু কম হয়। 1 mol গ্যাসের ক্ষেত্রে আয়তনের এই হ্রাসকে b রাশি দিয়ে সূচিত করলে, সমীকরণটি হবে p ( V – nb ) = nRT
গতিতত্ত্বের অপর একটি স্বীকার্যে ধরা হয়েছে যে , অণুগুলি পরস্পরের ওপর আকর্ষণ বল প্রয়োগ করে না। কিন্তু বাস্তব গ্যাসের ক্ষেত্রে অণুগুলি পরস্পরের ওপর আকর্ষণ বল প্রয়োগ করে। পাত্রের দেয়াল থেকে দূরে অবস্থিত গ্যাসের অভ্যন্তরে যে – কোনো অণুর ওপর চারদিক থেকে সমান আকর্ষণ বল প্রযুক্ত হয়। ফলে পাত্রের মোটামুটি মাঝখানে থাকা অণুগুলির ওপর সব আকর্ষণ বলের লব্ধি শূন্য। কিন্তু যখন একটি অণু পাত্রের দেয়ালের কাছে আসে তখন ওই অণুটিকে পাত্রের ভিতরের সব অণুগুলি ভিতরের দিকে ( অর্থাৎ তার গতির বিপরীত দিকে ) আকর্ষণ করে। ফলে অণুটির গতি কমে যায় ও অণুটি অপেক্ষাকৃত কম জোরে দেয়ালে ধাক্কা মারে । সুতরাং আন্তরাণবিক আকর্ষণ বল না থাকলে দেয়ালের ওপর যে চাপ প্রযুক্ত হত তা আন্তরাণবিক বল থাকার জন্য কিছুটা কমে যায়।
আরও পড়ুন:-
- স্থিতিস্থাপকতা (Elasticity) কাকে বলে? | পীড়ন কি | বিকৃতি কি
- হুকের সুত্র বিবৃতি ও ব্যাখ্যা কর | ইয়ং গুণাঙ্ক কি
- নিউক্লিয় বিভাজন (Neuclear fission) কাকে বলে? | নিউক্লিয়ার ফিশন ও ফিউশন বিক্রিয়ার পার্থক্য
নিম্নচাপে বাস্তব গ্যাস আদর্শ গ্যাসের মতো আচরণ করে কেন ?
বাস্তব গ্যাস প্রধানত দুটি কারণে আদর্শ গ্যাসের মতো আচরণ করে না। প্রথমত ধরা হয় , আদর্শ গ্যাসের অণুগুলি বিন্দুভর , অর্থাৎ অণুগুলির মোট আয়তন শূন্য। কিন্তু বাস্তব গ্যাসের অণুগুলি যত ক্ষুদ্রই হোক না কেন ওদের আয়তন আছে। দ্বিতীয়ত ধরা হয়, আদর্শ গ্যাস অণুগুলির আন্তরাণবিক বল শূন্য। কিন্তু বাস্তব গ্যাসের আন্তরাণবিক বল শূন্য নয়। এখন, কোনো আবদ্ধ পাত্রে কোনো বাস্তব গ্যাসকে নিম্নচাপে রাখার অর্থ হল
(a) আবদ্ধ পাত্রে অণুর সংখ্যা খুব কম এবং
(b) গ্যাসটির আন্তরাণবিক দূরত্ব খুব বেশি।
প্রথম কারণটির জন্য বাস্তব গ্যাসটির অণুগুলির মোট আয়তন পাত্রের আয়তনের তুলনায় নগণ্য হয়ে পড়ে। দ্বিতীয় কারণটির জন্য বাস্তব গ্যাসটির আন্তরাণবিক বল নগণ্য হয়ে পড়ে । ফলে নিম্নচাপে বাস্তব গ্যাস আদর্শ গ্যাসের মতো আচরণ করে।
Image source- britanica.com



Pingback: ব্রাউনীয় গতি কি | ব্রাউনীয় গতির বৈশিষ্ট্য | ব্রাউনীয় গতির ব্যাখা – Studious
Thanks sir