প্রিয় পাঠকেরা, আমরা ভৌতবিজ্ঞানের এই পর্বে আলোচনা করবো বিভিন্ন গ্যাস সূত্র সম্পর্কে, পড়বো বয়েলের সূত্র, চার্লসের সূত্র, রেনোর সূত্র ইত্যাদি। তবে আজ আমাদের এই পর্বে আলোচ্য বিষয় বয়েলের সূত্র, বয়েলের সূত্রের গাণিতিক রূপ, ব্যাখা, pv-v লেখচিত্র ইত্যাদি।
গ্যাস সূত্র (Gas laws) : নির্দিষ্ট শর্তে কোনো গ্যাসের উষ্ণতা, চাপ, আয়তন ও ভর সম্পর্কিত ভৌত আচরণ সংশ্লিষ্ট রাশিগুলির মধ্যে বজায় থাকা যে গাণিতিক সম্পর্কগুলির সাহায্যে বর্ণনা করা যায় তাদের একত্রে গ্যাস সূত্র বলে। পরিচিত তিনটি গ্যাস সূত্র হল—
1) বয়েলের সূত্র (গ্যাসের চাপ ও আয়তনের মধ্যে সম্পর্ক),
2) চার্লসের সূত্র (গ্যাসের আয়তন ও উয়তার মধ্যে সম্পর্ক),
3) রেনোর সূত্র বা চাপের সূত্র (গ্যাসের চাপ ও উয়তার মধ্যে সম্পর্ক)।
বয়েলের সূত্র কি (Boyle’s Law)
বয়েলের সূত্র ( Boyle’s law ) : স্থির উষ্ণতায় নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন গ্যাসটির চাপের সঙ্গে ব্যস্তানুপাতে পরিবর্তিত হয়।
বয়েলের সূত্রের গাণিতিক রূপ
গাণিতিক রূপ: নির্দিষ্ট উষ্ণতায় কোনো নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন V এবং চাপ P হলে, বয়েলের সূত্রানুযায়ী,
V∞1/P (যখন ভর ও উষ্ণতা স্থির)
বা , V = k ×1/P (যেখানে, K একটি সমানুপাতিক ধ্রুবক)
বা , PV = K, এটিই বয়েলের সূত্রের গাণিতিক রূপ।
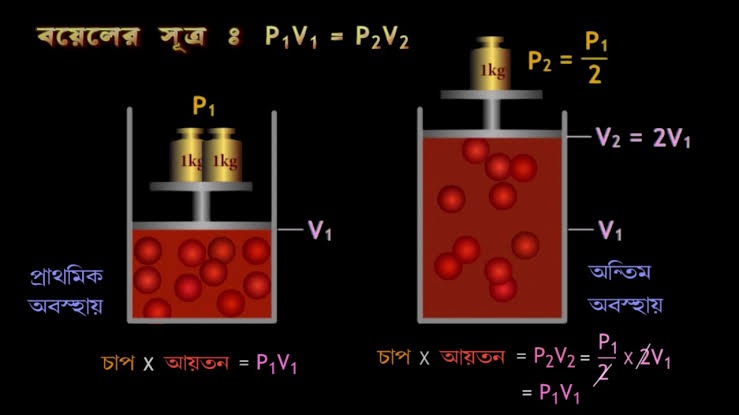
যদি , স্থির উয়তায় নির্দিষ্ট ভরের কোনো গ্যাসের P1 চাপে আয়তন V1 , এবং P2 চাপে আয়তন V2 হয়, তবে বয়েলের সূত্রানুযায়ী , P1×V1= P2×V2 = K (ধ্রুবক)।
বয়েলের সূত্র এর ব্যাখ্যা
ব্যাখ্যা – বয়েলের সূত্রানুযায়ী, নির্দিষ্ট ভরের গ্যাসের উয়তা স্থির রেখে আয়তন বাড়ালে বা কমালে চাপ ব্যস্তানুপাতে পরিবর্তিত একটি পিস্টন লাগানো ধাতব পাত্রে নির্দিষ্ট ভরের কোনো গ্যাস নিয়ে পিস্টনটির ওপর P চাপ প্রয়োগ করলে যদি গ্যাসটির আয়তন V হয়,
তবে উষ্ণতা স্থির রেখে ওই গ্যাসের চাপ দ্বিগুণ ( 2P ) করলে দেখা যাবে, গ্যাসের আয়তন V থেকে কমে V/2 হল।
অন্যদিকে , স্থির উষ্ণতায় যদি ওই সমভরের গ্যাসের চাপ P থেকে কমিয়ে P/2 করা হয়, তাহলে গ্যাসের আয়তন V থেকে বেড়ে দ্বিগুণ বা 2V হবে। অনুরূপে, গ্যাসের চাপ P/4 হলে গ্যাসের আয়তন চার গুণ বা 4V হয়। অর্থাৎ, প্রযুক্ত চাপের সঙ্গে আয়তনের পরিবর্তন এমন হয় যে, চাপ ও আয়তনের গুণফল যেন সর্বদা ধ্রুবক হয়।
আরও পড়ুন:-
- রাসায়নিক ধর্ম (Chemical properties) কাকে বলে
- ঘর্ষণ কাকে বলে? ঘর্ষনের প্রকারভেদ | ঘর্ষণের সুবিধা ও অসুবিধা
- অভ্যন্তরীণ পূর্ণ প্রতিফলন কাকে বলে ও শর্ত | মরুভূমির মরীচিকা
- প্লবতা (Buoyancy) কাকে বলে | প্লবতার বৈশিষ্ট্য | প্লবতার সূত্র
বয়েলের সূত্রের লেখচিত্র
PV বনাম P লেখচিত্র: বয়েলের সূত্রানুযায়ী, PV = K = ধ্রুবক (উষ্ণতা স্থির), P- এর ভিন্ন মানে PV-এর মান নির্ণয় করে PV- কে কোটি এবং P- কে ভুজ হিসেবে ধরে লেখচিত্র অঙ্কন করলে P অক্ষের (ভুজের) সমান্তরাল সরলরেখা পাওয়া যাবে।
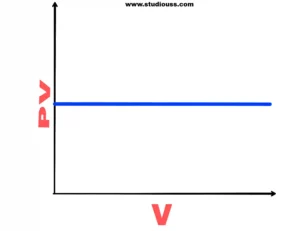
বয়েলের সূত্র pv-v লেখচিত্র
লেখচিত্র থেকে দেখা যায় যে, P-এর বিভিন্ন মানে PV-এর মান নির্দিষ্ট থাক। বিভিন্ন স্থির উন্নতায় প্রতিটি লেখ P- অক্ষের সমান্তরাল হবে এবং উন্নতা বৃদ্ধির সঙ্গে সঙ্গে P অক্ষ থেকে দূরে সরে যেতে থাকবে। এই কারণে উন্নতা বৃদ্ধিতে PV = K সমীকরণের ধ্রুবক K- এর মান বৃদ্ধি পায়।
P বনাম V লেখচিত্র : স্থির উন্নতায় নির্দিষ্ট ভরের গ্যাসের আয়তনকে (V) বিভিন্ন চাপে (P) নির্ণয় করে P-কে কোটি (ordinate বা Y – axis) ও V-কে ভুজ (abcissa বা X – axis) হিসেবে ধরলে PV = K সূত্রানুযায়ী, সম – পরাবৃত্তাকার (Rectangular hyperbola) লেখচিত্র পাওয়া যায়।
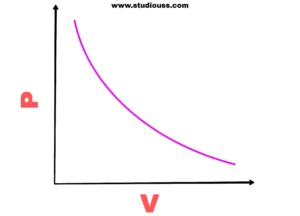
বয়েলের সূত্র p-v লেখচিত্র
লেখচিত্র থেকে দেখা যায় যে, স্থির উষ্ণতায় চাপ বাড়ালে আয়তন কমে ও চাপ কমালে আয়তন বাড়ে। বিভিন্ন স্থির উয়তায় প্রতিটি লেখ সম-পরাবৃত্ত হবে এবং উষ্ণতা বৃদ্ধির সঙ্গে সঙ্গে উচ্চ উন্নতার লেখগুলি নিম্ন উষ্ণতার লেখগুলি অপেক্ষা উপরের দিকে অবস্থান করবে। কারণ – উয়তা বৃদ্ধিতে ধ্রুবক K- এর মান বৃদ্ধি পায় । নির্দিষ্ট উন্নতায় প্রাপ্ত P বনাম V লেখচিত্রকে গ্যাসের সমোষ্ণ লেখ বা isotherm বলে।



Pingback: চার্লসের সূত্র (Charles' Law) | চার্লসের সূত্রের ব্যাখা ও গাণিতিক রূপ – Studious
Pingback: বয়েল ও চার্লসের সমন্বয় সূত্র | আদর্শ গ্যাস | বাস্তব গ্যাস – Studious
Pingback: আদর্শ গ্যাসের সমীকরণ PV=nRT প্রতিষ্ঠা করো | সর্বজনীন গ্যাস ধ্রুবক – Studious
Pingback: পরম শূন্য উষ্ণতা কাকে বলে? (Absolute zero temperature) | পরম শূন্য উষ্ণতাকে 'পরম' বলার কারণ – Studious